Maintenant que tu sais un peu ce que représentent tous ces rubans⬇️⬇️, on va aller un peu plus loin, et je vais le faire en utilisant (un peu) l’exemple de la protéine Spike des Coronavirus. Ready? On y va !
[ATTENTION] Je te préviens: si tu n’as pas encore vu les épisodes 1 et 2 sur les protéines, vaut mieux y aller avant⬇️⬇️, sinon ça va être compliqué. Je te mets le lien ici pour accéder au Meta thread qui les rassemble.
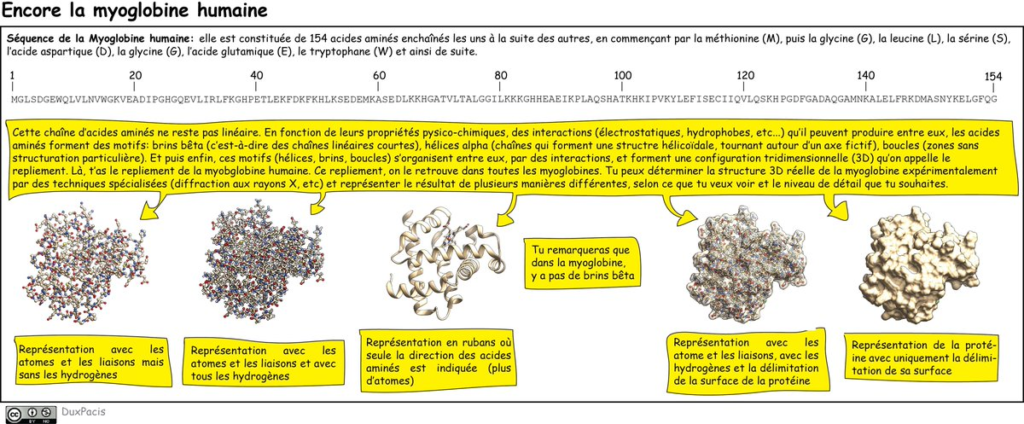
Je t’ai dit que les protéines sont des assemblages d’acides aminés (AA) et que la séquence des AA détermine la manière dont ce collier de perles (AA=perles) se replie en 3D. On appelle ça le REPLIEMENT (fold en anglais) de la protéine. Résumé⬇️⬇️⬇️
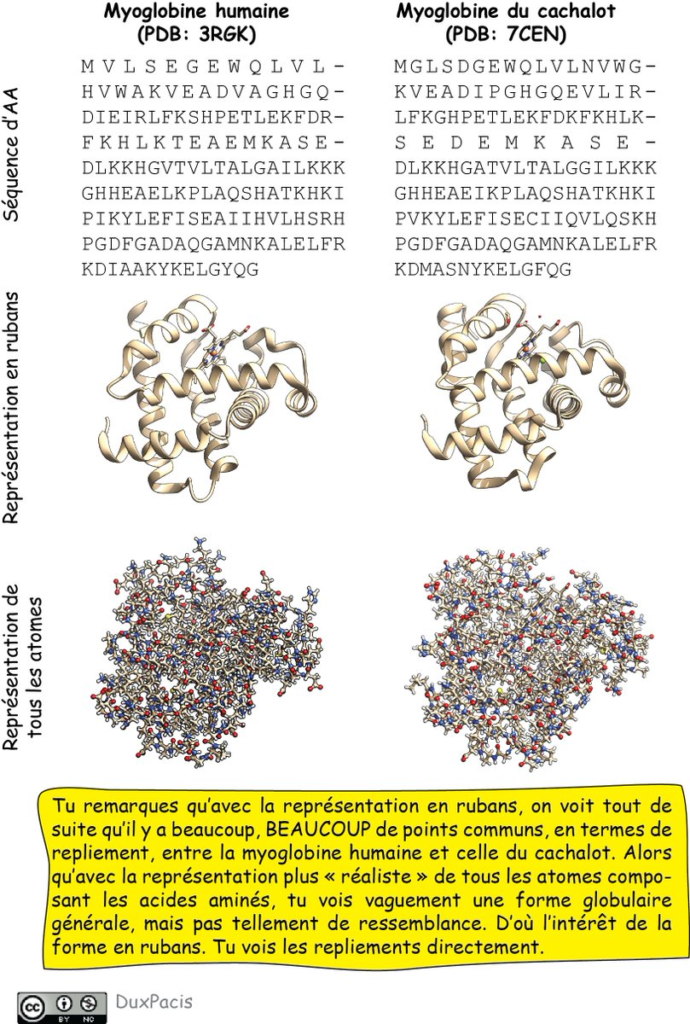
Du coup, les protéines qui ont une séquence proche ont le même repliement (la même organisation 3D des hélices, boucles, brins, etc.). Je t’avais donné l’exemple de la myoglobine humaine, du cachalot, et de l’hémoglobine. Je t’ai fait un résumé (figure ⬇️)
Avec ces histoires de repliement, je ne voudrais pas que tu t’imagines qu’il s’agit d’une structure rigide. Les atomes, ce sont des objets quantiques qui gesticulent (vibrent) sans arrêt. Du coup, les molécules et les macromolécules aussi.
Ça signifie qu’il y a une certaine flexibilité là-dedans malgré les forces qui contraignent le repliement. Du coup, les positions des brins, des boucles et/ou des hélices peuvent fluctuer. Ça peut se produire lorsqu’une protéine interagit avec une autre molécule.
Là⬇️, je te mets un film avec une protéine appelée hexokinase (HK, en gris), qui peut interagir avec le glucose (en rose), ce qui provoque un changement de conformation/organisation de l’HK (mais pas du repliement).
Et là, c’est la citrate synthase (bleu et rose) qui se lie à plusieurs petites molécules et change aussi de conformation quand ça se produit (sans que le repliement ne change). Source des films: molvisual.chem.ucsb.edu/movies.html
Je t’ai dit aussi que les AA ont des propriétés (la charge électrique) qui dépendent du pH. Au pH (neutre) des cellules, t’as donc un repliement donné mais si tu changes le pH (plus acide ou plus basique), les charges changent, et le repliement peut changer aussi.
Donc, le repliement d’une protéine dans la cellule, ça dépend du pH, de la présence d’ions (molécules chargées) qui contrebalancent les charges des AA, etc. Bref, ça dépend aussi des conditions. Une protéine, c’est une structure dynamique
En moyenne, le repliement est stable, mais tu peux avoir des changements locaux du repliement en fonction des conditions (conformation). Mais ce n’est pas tout. Une protéine, ça ne « vit » pas seul, dans une cellule. Elle peut rencontrer et interagir avec d’autres protéines. Là aussi, t’as des effets de complémentarité de charges, de régions hydrophobes qui « aiment » se rassembler, des interactions électrostatiques, etc. On te représente souvent ça comme une complémentarité de forme de type clé/serrure.
Mais en réalité, en plus de la forme, t’as les charges, l’hydrophobie, et les micro-mouvements qui sont à prendre en compte. Et si une interaction se fait, deux (ou plus) protéines peuvent se maintenir ensemble dans ce qu’on appelle un complexe.
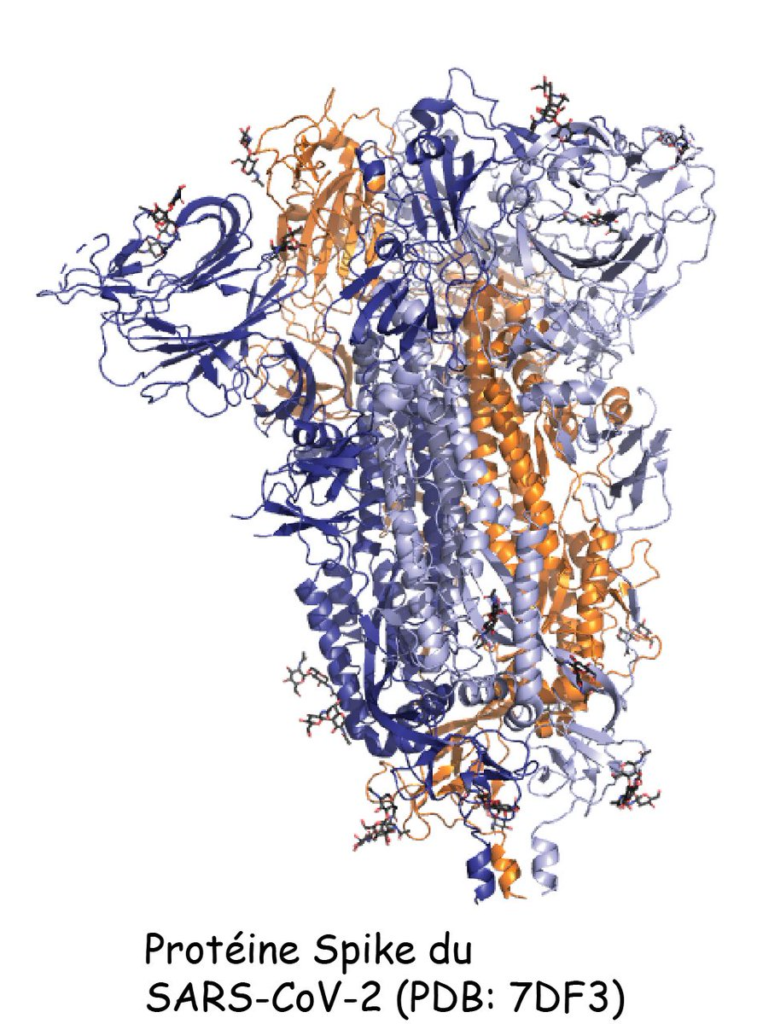
Mais je vais te donner un autre exemple: la protéine Spike du virus SARS-CoV-2. Sous sa forme finale (à la surface du virus), elle est constituée d’une chaîne de 1260 AA qui s’organisent selon le repliement que je te mets là⬇️⬇️⬇️
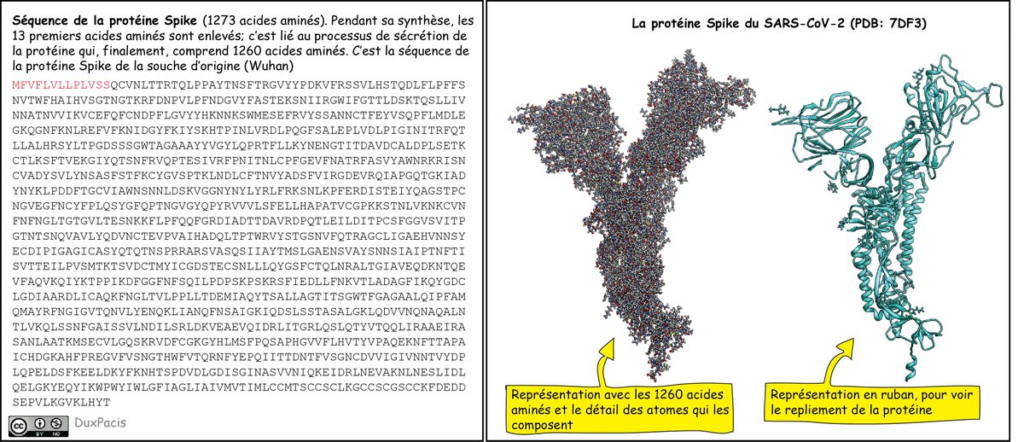
Là, tu vas certainement me dire: « Mais ça ne ressemble pas du tout à la Spike qu’on voit partout! ». C’est normal. C’est parce que la protéine Spike est, en réalité, la protéine DE SPICULE, mais pas LA spicule elle-même. Pour faire un spicule, il faut 3 protéines Spike.
Il faut donc 3 exemplaires identiques de la protéine Spike qui, lorsqu’ils se rencontrent, s’assemblent en ce qu’on appelle un trimère, lequel forme LA Spike (spicule). Et ces 3 protéines, elles sont maintenues ensemble très fortement⬇️⬇️⬇️.
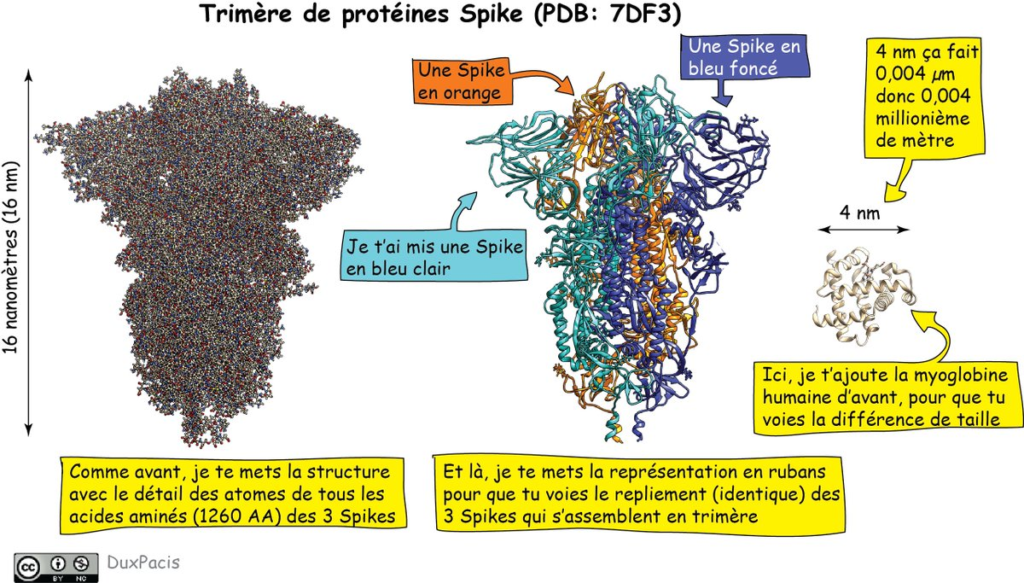
On dit aussi qu’elles forment un « complexe » (assemblage) de 3 Spikes —reliées entre elles par des interactions de type électrostatique (entre charges) et Van der Waals (càd entre régions hydrophobes). Pas par des liaisons covalentes comme entre les atomes.
Quand un Gecko reste collé sur une vitre, c’est aussi ce genre d’interactions qui le maintiennent. Ce sont des interactions dites « faibles » par rapport aux liaisons entre les atomes, mais comme il y en a des centaines entre chaque protéine, c’est du solide.
Ce trimère de Spike, il peut changer de conformation. Ça veut dire que le repliement de la Spike peut changer localement. Là⬇️⬇️⬇️, par exemple, t’as un mouvement d’une région qu’on appelle le RBD (on verra une autre fois ce que ça veut dire).
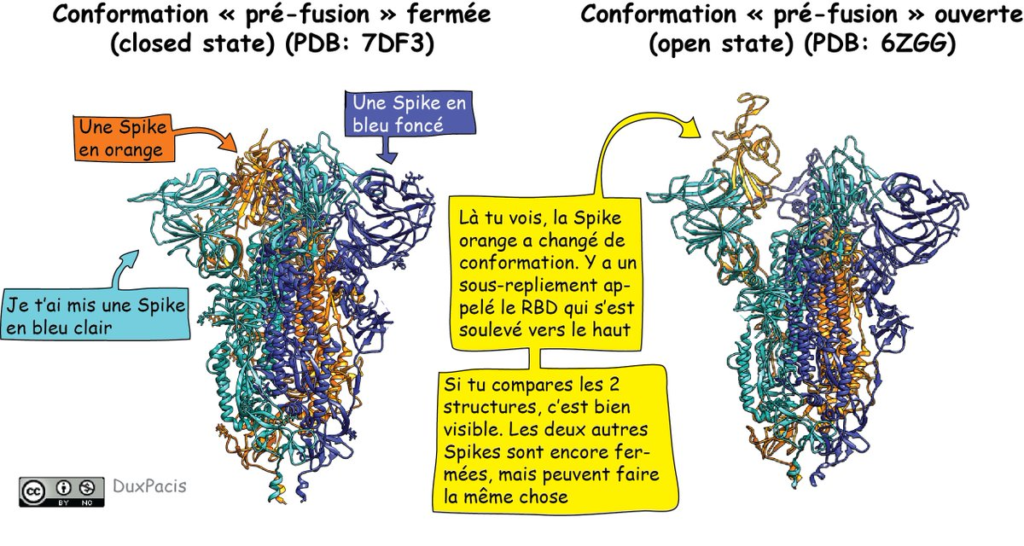
C’est justement cette conformation « ouverte » qui permet à une Spike d’interagir avec la protéine ACE2 qui se trouve à la surface de nos cellules. Comme t’as 3 Spikes et 3 RBD, tu peux interagir avec 3 ACE2 aussi. Je te mets la référence de cette affirmation: https://www.nature.com/articles/s41586-020-2772-0
Pourquoi la Spike interagit-elle avec ACE2? Il se trouve qu’étant données les propriétés de forme, de charge, etc. du RBD, son partenaire le plus « solide », c’est ACE2. Mais elle pourrait aussi en avoir d’autres, simplement, c’est plus efficace avec ACE2.
Ca veut dire que si tu changes les acides aminés (et donc les propriétés) du RBD (avec des mutations, par ex.), tu peux avoir une Spike qui interagit mieux avec autre chose. Et c’est ce qui se passe pour d’autres Coronavirus.
Du coup, avec cette interaction Spike/ACE2, ça bloque la Spike dans cette nouvelle conformation dite « ouverte », et permet d’autres évènements dont la coupure de la Spike par la protéine TMPRSS. Je ne rentre pas dans les détails, on verra ça une autre fois.
Si tu regardes les protéines Spike d’autres coronavirus avec la représentation en rubans (je t’ai fait une illustration⬇️⬇️⬇️), tu vois qu’elles se ressemblent: des trimères, avec repliements similaires. Y a de petites différences d’orientations (de conformations) des hélices, brins, boucles mais le repliement de la Spike et globalement le même, malgré le fait que leurs séquences ne soient pas vraiment identiques. Y en a 5 qui sont des Spikes de virus qui infectent les humains.
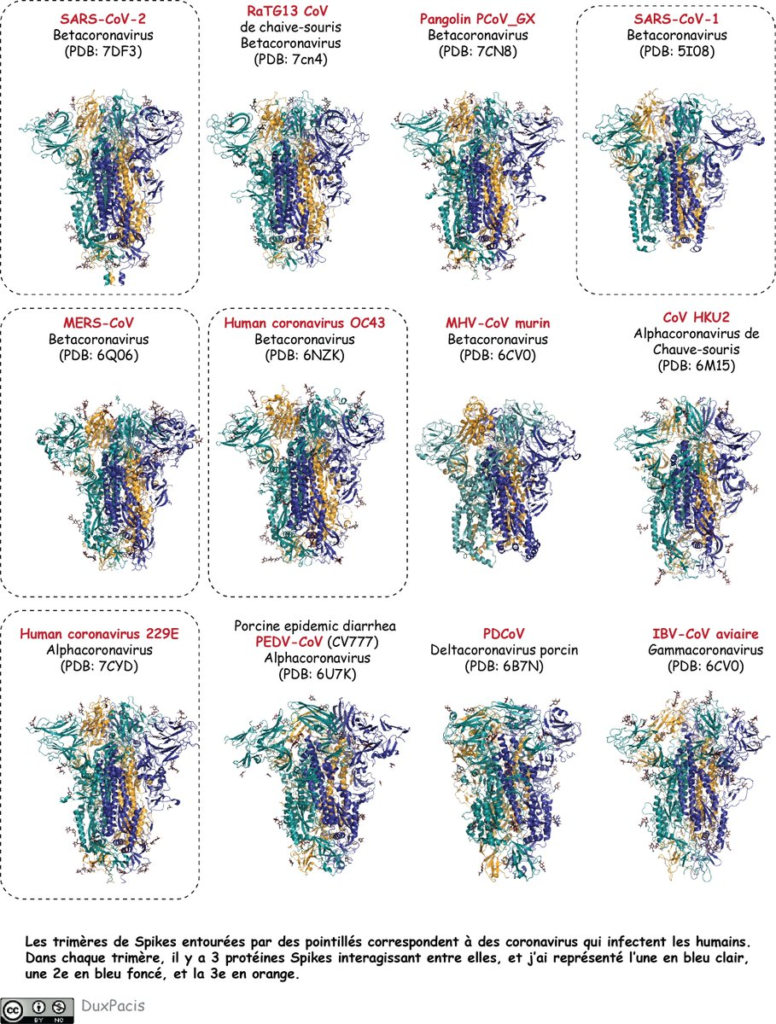
Celle du SARS-CoV-2, qui provoque le Covid-19 (tu sais bien), celle du SARS-CoV-1 (SRAS), du MERS-CoV, du CoV OC43 (qui provoque des rhumes), et le CoV 229E (rhumes aussi). Elles ne se lient pas toutes au même récepteur à cause des ces petites différences.
Pour finir: il n’y a pas que des acides aminés sur la Spike. Il y a aussi des sucres. Ils sont ajoutés APRES la synthèse de la protéine. Ce sont des modifications courantes, et il y en a plein d’autres types. Ça veut dire qu’en plus des AA, t’as d’autres molécules qui peuvent être ajoutées en décoration et qui changent les propriétés de la chaîne et peuvent influencer son repliement, sa capacité à interagir avec d’autres protéines, changer celles avec lesquelles elles peuvent interagir, etc.
Du coup, tu vois qu’une protéine, après sa synthèse (enchaînement des AA pendant la traduction), ça peut aussi être « maturé » (ajout de décorations, découpages, comme avec la Spike). Ça s’appelle des modifications post-traductionnelles. Y en a des milliers possibles.
[CONCLUSION]
Et voilà, c’est fini. J’espère que la Spike t’aura bien servi à comprendre cette histoire de repliement et de conformation. On se retrouve bientôt pour de nouvelles aventures.
Références
Sur la Spike en général : https://www.frontiersin.org/articles/10.3389/fimmu.2020.576622/full
Changement de conformation de la Spike : https://www.nature.com/articles/s41586-020-2772-0
Logiciels: J’ai utilisé la Protein Data Bank (PDB) pour récupérer les structures expérimentales des protéines utilisées (codes indiqués) et le logiciel UCSF Chimera ou PyMol pour les traiter.
Les films pour les changements de conformation venaient de là : molvisual.chem.ucsb.edu/movies.html
Et si tu veux des infos structurales sur les variants de la Spike, tu peux aller là : RCSB PDB : https://pdb101.rcsb.org/motm/246
Originally tweeted by DuXpa6 (@duxpacis) on 1 December 2021.
